Arquivos de Impressão: Tamanho A4 (pdf), Tamanho A5 (pdf), Texto (txt).
A utilização de substitutos ósseos para recuperação da função perdida é uma constante busca dentro da Odontologia e, mais especificamente, na Implantologia atual. Por isso os biomateriais têm recebido uma atenção muito grande por parte da comunidade científica internacional. O uso clínico de hidroxiapatita, principalmente em seio maxilar, para ganho de altura óssea e instalação de implantes dentários tem demonstrado resultados muito satisfatórios; tanto sem misturas ou quando utilizada agregada com outros materiais, tais como PRP (plasma rico em plaquetas), osso autógeno ou outros materiais para enxertia. O pó de hidroxiapatita, nesse estudo, foi preparado pelo método da precipitação. Microscopia eletrônica de varredura, espectroscopia na região do infravermelho e difração de raios-X foram utilizados para caracterização do material obtido. Casos clínicos foram realizados com objetivo de verificar a promoção de tecido ósseo para instalação de implantes. O resultado mostrou que o pó obtido é composto exclusivamente de hidroxiapatita não ocorrendo a precipitação de fases do sistema Ca-P. Estudos histológicos das áreas enxertadas e radiografias demonstraram que o leito receptor apresentou adequado crescimento de tecido ósseo, possibilitando a instalação dos implantes e posterior suporte de cargas mastigatórias.
A hidroxiapatita, Ca10(PO4)6(OH)2, representa de 30 a 70% da massa dos ossos e dentes e é o principal constituinte mineral destas estruturas. Por ser sintética e possuir propriedades de biocompatibilidade, a produção de hidroxiapatita vem sendo estudada por diversos grupos de pesquisadores na busca da obtenção de um produto onde não coexistam fases diversas baseadas no sistema Ca-P. A síntese de fosfatos de cálcio via precipitação química apresenta vantagens, quando comparada aos métodos tradicionais de produção de hidroxiapatita, devido ao seu baixo custo e simplicidade, no entanto a maioria dos procedimentos sintéticos apresenta a formação de produtos não estequiométricos e mistura de fases. Os processos de precipitação consistem na adição de grupos fosfatos a suspensões que contenham íons cálcio, podendo partir de diferentes reagentes. Dependendo do processo de fabricação, as propriedades da hidroxiapatita apresentam características diferentes. Quando sintetizadas em altas temperaturas, apresentam boa cristalinidade e cristais grandes. Quando sintetizadas em baixas temperaturas, apresentam baixa cristalinidade e cristais pequenos. Atualmente os métodos de precipitação por via úmida são preferidos, devido ao produto produzido apresentar características similares às do tecido ósseo e dentário.
O potencial das cerâmicas como biomateriais é baseado em sua compatibilidade com o meio fisiológico. Esta compatibilidade é resultante do fato de que esses materiais podem conter íons comumente encontrados no meio fisiológico (cálcio, potássio, magnésio, sódio, etc) além de íons com limitada toxicidade para os tecidos do corpo (alumínio ou titânio). Portanto, biocerâmicas são definidas como materiais cerâmicos designados para atuar em um meio fisiológico específico, e utilizadas como material de construção de aparelhos, de proteção ou órgãos internos artificiais [2]. Dentre as biocerâmicas a hidroxiapatita (HA = Ca10(PO4)6(OH)2) e o β-fosfato tricálcico (β-TCP = β-Ca3(PO4)2) são os materiais mais comumente utilizados pois, além da composição química semelhante à fase mineral óssea, fornecem respostas diferenciadas e satisfatórias, além disso, sabe-se que esses materiais possibilitam o crescimento ósseo e facilitam a integração do implante [2],[7].
Para a obtenção dos materiais à base de fosfato de cálcio, dependendo dos métodos utilizados, dos reagentes e das variáveis adotadas, é possível obter inúmeras fases, além de uma grande variação de comportamentos resultantes de outras variações, tais como: defeitos cristalinos, área superficial, afinidade por materiais orgânicos encontrados no meio fisiológico, etc.
A síntese de fosfatos de cálcio via precipitação química é vantajosa, devido ao seu baixo custo e simplicidade; no entanto, a maioria dos procedimentos sintéticos apresenta a formação de produtos não estequiométricos e mistura de fases, o que se deve à presença de vacâncias e substituições iônicas na rede, tais como carbonatos, hidrogeno-fosfatos, potássio, sódio, nitrato e cloreto [3].
Os processos de precipitação consistem na adição de grupos fosfatos a suspensões que contenham íons cálcio, podendo partir de diferentes reagentes. A reação de neutralização que utiliza ácido ortofosfórico e hidróxido de cálcio apresenta maior potencial para produção da hidroxiapatita (HA) uma vez que se tem apenas água como subproduto da reação.
Os métodos de precipitação apresentam variáveis, tais como pH, temperatura de obtenção, concentração molar dos reagentes, taxa de adição de reagentes, tempo de agitação, tempo de envelhecimento e temperatura de calcinação. O tempo de envelhecimento e a cinética de reação são variáveis críticas para a pureza e características cristalográficas do material obtido.
A composição dos reagentes trata da pureza do material, que pode apresentar, ou não, íons não esperados na rede, além de diferenças nas características morfológicas e cristalográficas. A taxa na qual os reagentes são adicionados, ou seja, o tempo de gotejamento, influencia na taxa de nucleação dos cristais [3]. A velocidade de gotejamento está diretamente relacionada à cinética da reação, a adição lenta de íons fosfato proporciona menor taxa de nucleação e maior taxa de crescimento, o que implica na obtenção de partículas maiores; pelo contrário, altas taxas de adição de reagentes permitem a formação de maiores números de núcleos, mas sem que haja tempo suficiente para crescimento de grão.
A formação de um sólido envolve precipitação a partir de uma solução e cristalização, esses dois processos ocorrem simultaneamente se o precipitado é cristalino, por outro lado, se o sólido obtido não é cristalino, a razão com a qual tais etapas acontecem determina a cristalinidade do material. Esta razão pode ser controlada pela variação da saturação da solução e pelo tempo médio de cristalização, que tem como parâmetros a temperatura e a taxa de gotejamento [10].
A temperatura na qual a precipitação se processa tem grande importância na fase obtida e na conversão de uma em outra. O tamanho da partícula e a morfologia também são influenciados pela temperatura. Temperaturas mais altas permitem a obtenção de pós mais cristalinos.
Durante o envelhecimento, os cristais formados estão sujeitos a um processo de dissolução e recristalização, no qual os cristais menores desaparecem em detrimento dos maiores, os quais crescem mais rapidamente; em consequência disto, o número total de cristais diminui, assim como a área superficial específica [3]. O crescimento das partículas durante o envelhecimento comprova que a precipitação continua mesmo após o gotejamento de todo o volume de ácido [9].
A calcinação do pó obtido pode alterar a fase presente no sólido, pois cada uma das fases dos fosfatos de cálcio apresenta diferentes estabilidades térmicas e propriedades físicas. Uma pequena variação na razão Ca/P do pó sintetizado resulta numa grande variação das proporções das fases formadas após a calcinação [8].
A formação da HA por precipitação pode ocorrer mediante fases precursoras intermediárias, que apresentam existência transitória e efêmera durante a etapa de obtenção [3]; essas fases, dependendo das condições utilizadas, podem ser detectadas quando o material sofre tratamentos térmicos e influenciam na qualidade do produto final.
O desempenho biológico de materiais sintéticos para uso biomédico depende de parâmetros fundamentais, como composição química, morfologia e biodegradabilidade. A análise destas propriedades pode ser feita mediante diversas técnicas de caracterização.
Hidroxiapatita deficiente em cálcio (CDHA) pôde ser preparada por precipitação sob condições básicas com posterior tratamento térmico, com temperaturas próximas de 1000oC [6]. A hidroxiapatita (HA) pura tem razão Ca/P = 1,67, parâmetro de rede: eixo a = 0,9422nm e eixo c = 0,688nm. O pó obtido apresentou bandas de absorção de OH e HPO42− no espectro de infravermelho e formação de mistura de β-TCP e HA nos pós calcinados acima de 700oC, a razão entre essas duas fases aumentou com a diminuição da razão Ca/P. Fosfato de cálcio amorfo pôde ser preparado em temperatura ambiente por precipitação mediante o gotejamento de solução de nitrato de cálcio sobre uma solução básica de fosfato sob agitação, e subsequente filtração e secagem do sólido obtido; a análise por difração de raios X desse material exibiu uma banda larga, pelo fato de o mesmo ser amorfo, e a microscopia eletrônica de transmissão mostrou partículas esféricas. No entanto, essa fase é instável e rapidamente se converte em OCP e em seguida a HA. Foi obtida também a fase DCPD de razão Ca/P 1,0 e partículas cristalinas de formas achatadas a partir do gotejamento de soluções de íons cálcio sobre soluções contendo grupos fosfatos à temperatura ambiente e pH inicial 6. Já a fase DCPA foi preparada da mesma maneira que a fase DCPD, apenas aumentando a temperatura de precipitação para 60oC, e a fase OCP surgiu quando o pH foi diminuído para 4 e a temperatura aumentada para 80oC.
De acordo com Saeri et al. [9], HA foi obtida mediante a adição de uma solução de ácido fosfórico (0,3M) em uma suspensão de hidróxido de cálcio (0,5M) a uma taxa de duas gotas por segundo a 40oC em pH=7,5, mantido constante por meio da adição de hidróxido de amônio. Em seguida, o material obtido foi lavado com água destilada e a ele foi adicionado 1mmol/l de ácido fosfórico, esta solução foi envelhecida por uma noite. O pó sintetizado foi calcinado a 850oC e a 1200oC. Saeri et al. [9] caracterizaram pó de hidroxiapatita por microscopia e observaram que a morfologia e o tamanho de partícula foram alterados em cada etapa do processo de obtenção e afetando, significativamente, as propriedades de sinterização. As partículas apresentaram morfologia achatada e alongada, com escala nanométrica, porém as amostras com maior tempo de envelhecimento exibiram partículas maiores. Além disso, as nanopartículas tenderam a formar aglomerados. Também foi observado que o tempo de envelhecimento e a cinética de precipitação foram determinantes para a pureza do material e suas características cristalográficas. Além disso, quanto maior a temperatura de calcinação mais cristalina era a amostra, o que foi dado pela diferença de intensidade dos picos no difratograma de raios X. Ainda foi reportado que a área superficial específica das amostras estequiométricas tinha valores mais altos que as não estequiométricas.
Landi et al. [5] obtiveram hidroxiapatita carbonatada mediante a reação de neutralização de hidróxido de cálcio (Ca(OH)2) e ácido fosfórico (H3PO4). Uma suspensão de Ca(OH)2 foi aquecida a 40oC e dióxido de carbono (CO2) foi borbulhado sobre esta suspensão, concomitantemente ao gotejamento de uma solução de H3PO4, por um período de 4 horas. Em seguida, o sistema foi agitado por 2 horas, envelhecido por um dia, à temperatura ambiente, lavado e desaglomerado. O processo de obtenção teve como variáveis o fluxo de CO2, a taxa de adição de H3PO4, a concentração da solução e a temperatura de síntese. O aumento no fluxo de dióxido de carbono levou à formação de hidroxiapatita carbonatada com substituição dos grupos OH; o aumento da taxa de adição de ácido fosfórico provocou a menor incorporação de carbonato na estrutura da HA, principalmente sobre os grupos fosfato. Por outro lado, a diminuição desta taxa propiciou a substituição de grupos fosfatos por grupos HPO42−, característicos da hidroxiapatita deficiente em cálcio. Além disso, houve um aumento na cristalinidade e no tamanho de partícula com o aumento da temperatura de síntese, em detrimento da quantidade de carbonato presente na amostra. Por meio dos difratogramas de raios X foi observado que a cristalinidade da hidroxiapatita carbonatada é menor que da HA pura. Nos espectros no infravermelho foram perceptíveis bandas relativas aos grupos carbonatos e fosfatos.
Afshar et al. [1] prepararam hidroxiapatita a partir de suspensão de hidróxido de cálcio 0,5M, a qual foi aquecida por 1 hora em 40oC e agitada constantemente, e sobre ela foi adicionado ácido fosfórico 0,3M a uma taxa de 2 gotas/s. O pH foi controlado por meio da adição de NH4OH. O precipitado foi envelhecido por um período de um dia na solução mãe, na qual decantou. O estudo do material obtido apresentou, como resultados, partículas com forma de bastão de escala nanométrica mediante a análise das micrografias. A quantidade de íons cálcio presente no material diminuiu com a diminuição do pH durante a precipitação, o que foi concluído por meio de cálculos envolvendo difração de raios X.
Uma solução de ácido fosfórico 0,06M foi adicionada a uma taxa de 4ml/min. a uma solução de hidróxido de cálcio 0,1M para a obtenção de fosfatos de cálcio, por Kumar et al. [4] Foram feitas pequenas inclusões de carbonato de cálcio para se obter apatita carbonatada. Estudou-se o efeito da temperatura de precipitação, usando 40oC, 80oC e 100oC. Durante a adição de reagentes, o pH foi mantido constante em 7,4. A suspensão foi agitada por 2 horas e envelhecida por mais 15 horas. Mediante difração de raios X, observou-se a formação de HA como fase majoritária e pequena quantidade de β-TCP em todas as temperaturas de precipitação. Com o aumento da temperatura de reação houve um aumento na cristalinidade da HA e uma diminuição na substituição de grupos carbonato na estrutura da apatita. Por microscopia eletrônica de transmissão foi possível observar que as partículas obtidas a 40oC apresentavam forma acicular, diferentemente daquelas obtidas a 100oC, cuja forma era esferoidal.
Produzir, caracterizar e estudar casos clínicos utilizando hidroxiapatita obtida pelo método da precipitação.
O pó de hidroxiapatita foi obtido em sala limpa (ISO 5) por precipitação química, utilizando-se como reagentes Ca(OH)2 (Labsynth, Brasil) e H3PO4 (Labsynth, Brasil), todos de grau analítico, de acordo com a equação (6) (Produzida pela Bionnovation Produtos Biomédicos S/A):
Inicialmente mistura-se Ca(OH)2 com H2O destilada e deionizada em um balão de fundo redondo que foi aquecido e mantido sob agitação a uma temperatura constante. Em seguida, o volume de solução de H3PO4 com uma razão de 5ml/min, mantendo-se o sistema com uma agitação e uma temperatura constante para a etapa de envelhecimento. Após esse período a suspensão foi filtrada, seca em estufa a 110oC/24h, o material foi desaglomerado em almofariz de ágata e passado em malha e tratado termicamente.
A morfologia do pó foi analisada utilizando-se um microscópio eletrônico de varredura operando a 25KeV e a estrutura analisada utilizando espectroscopia na região do infravermelho e difração de raios X. Casos clínicos utilizando-se hidroxiapatita para aumento de volume ósseo em seio maxilar para a posterior instalação de implantes dentários foram realizados em pacientes com objetivo de promover condições ideais para instalação de implantes.
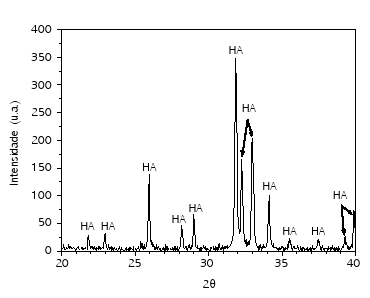
A figura 1 apresenta o espectro DRX para o pó de hidroxiapatita. Observa-se que todos os picos estão associados à fase da HA, não havendo a formação de outros compostos baseados no sistema Ca-P.

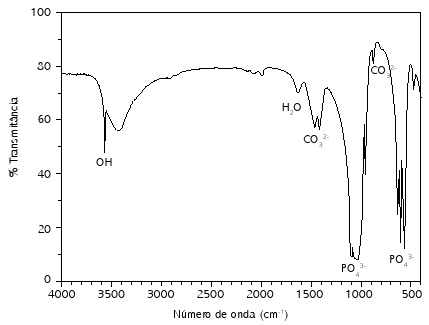
No espectro de absorção no infravermelho (Fig. 2) estão presentes as bandas que caracterizam a fase HA; em 491cm−1, 563cm−1, 603cm−1, 1043cm−1 e 1088cm−1 tem-se os picos referentes ao grupamento PO43−, 636cm−1 e 3574cm−1, referentes ao grupamento OH−. A banda em 871cm−1 representa vibrações moleculares do grupo CO32−, o que indica a presença deste grupo na fase, sendo, portanto, hidroxiapatita carbonatada, devido à substituição iônica do carbonato, na estrutura da HA.
A microestrutura do pó obtido por este processo foi examinada por microscopia eletrônica de varredura (Fig. 3). Observamos que o pó é composto por pequenas partículas, formando diversos aglomerados.

Nestes casos clínicos utilizou-se hidroxiapatita da marca Bionnovation (REGISTRO ANVISA No 10392710010) para aumento de volume ósseo em seio maxilar para a posterior instalação de implantes dentários.
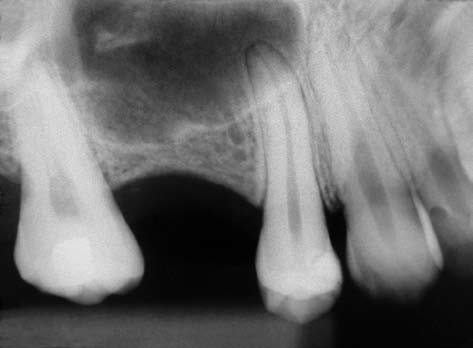
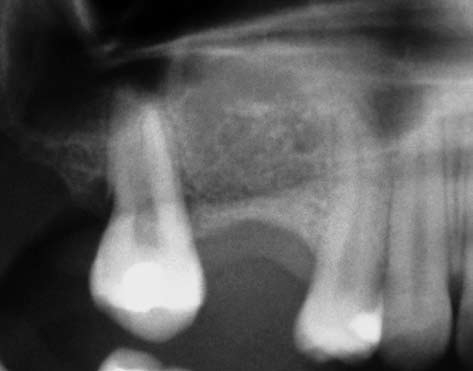
A figura 4 mostra uma radiografia da região, onde pode ser observada a grande pneumatização do seio maxilar, impossibilitando a instalação de implantes.
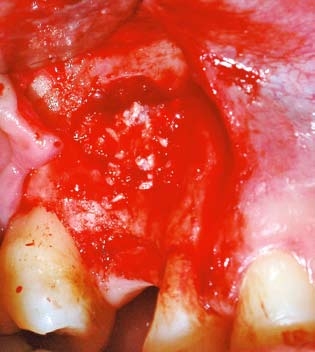
A figura 5 mostra o momento de preenchimento do seio maxilar com hidroxiapatita, buscando aumento do tecido ósseo.
As figuras 6 e 7 mostram a mesma região enxertada após uma semana e seis meses após o procedimento cirúrgico, respectivamente.

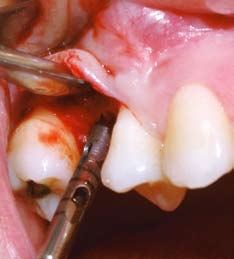
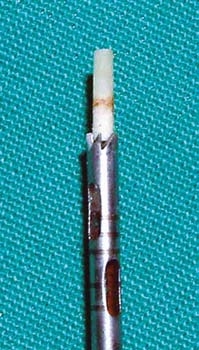
A figura 8 mostra o momento da fresagem para retirada de bloco ósseo para análise histológica. Observa-se nas figuras 9 e 10 a trefina para preparo do leito que irá receber o implante e coleta do bloco para estudo histológico.

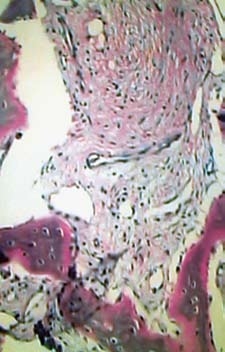
A figura 11 apresenta o resultado da análise histológica de uma lâmina corada com azul de toluídina, onde pode ser observado o crescimento de tecido ósseo na região onde foi realizado o enxerto de HA, seis meses após a cirurgia.
As figuras 12, 13 e 14, caso clínico II, mostram radiografias da região apresentando o aumento do volume ósseo no seio maxiliar, a instalação de dois implantes juntamente com o material de preenchimento e a prótese instalada em função mastigatória.
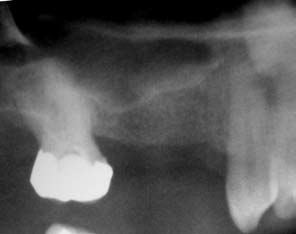
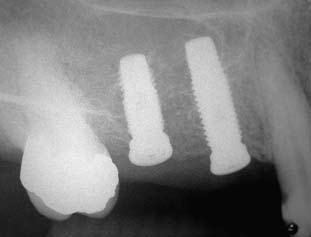
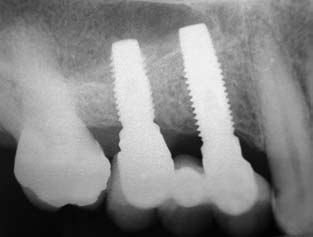
Observa-se pelas radiografias, em ambos os casos apresentados, nas situações anteriores e posteriores à cirurgia de enxertia com a hidroxiapatita, um aumento considerável de tecido ósseo, possibilitando a instalação dos implantes e posterior colocação da prótese em função.
A caracterização do material mostrou que o pó produzido pelo método da precipitação apresenta fase associada apenas à hidroxiapatita, não coexistindo outras fases referentes a sistemas Ca-P. O pó é composto de partículas finas, formando aglomerados uniformes e dispersos. Os casos clínicos demonstraram que esse produto é eficiente para promover crescimento de tecido ósseo.
Os autores agradecem à empresa Bionnovation Produtos Biomédicos S/A, pelo apoio durante as fases de preparação deste trabalho e pelo material gentilmente cedido.
The use of bone substitutes for recovery of lost function represents a constant search within the field of Dentistry, more specifically in contemporary Implantology. For this reason, biomaterials have received a great deal of attention from the international scientific community. The clinical use of hydroxyapatite, mainly in the maxillary sinus, for bone height gain and placement of dental implants has demonstrated very satisfactory results; either when used by itself or in conjunction with other materials, such as PRP (Platelet-Rich Plasma), autogenous bone, or other grafting materials. In this study, hydroxyapatite powder was prepared using the precipitation method. Scanning electron microscopy, infrared spectroscopy and x-ray diffraction were used to characterize the obtained material. Clinical cases were undertaken with the objective of verifying the promotion of bone tissue growth for implant placement. Results showed that the obtained powder is composed exclusively of hydroxyapatite, and that phase precipitation of the calcium phosphate system did not take place. Histological studies of the grafted areas and x-rays demonstrated that the receptor site displayed adequate bone tissue growth, making possible the placement of the implants and subsequent support of masticatory loads.
Este experimento rudimentar foi realizado na universidade da cidade, com esperança de obtermos hidroxiapatita destinada à odontologia. Os ossos e o esmalte dos dentes são formados predominantemente por esta substância. A hidroxiapatita é com certeza o material mais biocompatível da ortopedia e odontologia. Por isso acreditamos, que um composto de hidróxido de cálcio PA (Para Análise) e hidroxiapatita, pode compor uma obturação dentária que possibilite o organismo de regenerar a dentina e o esmalte dos dentes.
Síntese de hidroxiapatita Ca10(PO4)6(OH)2 mediante a adição de uma solução de ácido fosfórico H3PO4 à 0,3 Molar em uma suspensão de hidróxido de cálcio Ca(OH)2 à 0,5 Molar, à uma taxa de duas gotas por segundo à 40 graus Celsius.
São necessários, os cálculos estequiométricos e a verificação do peso em gramas por mol de cada componente, para a realização da reação química de síntese da hidroxiapatita.
| 10[Ca(OH)2] + 6[H3PO4] | = Ca10(PO4)6(OH)2 + 18[H2O] |
| 10x[74] + 6x[98] | = 1004 + 18x[18] |
| 740 + 588 | = 1004 + 324 |
| 1328 | = 1328 |
Isso significa que 740 gramas de hidróxido de cálcio mais 588 gramas ácido fosfórico podem produzir cerca de 1004 gramas, mais do que 1 Kilograma, de hidroxiapatita e 324 gramas de água. Ou seja, se neutralizarmos 7,4 (740/100) gramas de hidróxido de cálcio com ácido fosfórico, produziremos cerca de 10 (1004/100) gramas de hidroxiapatita.
Se 74 g/mol de [Ca(OH)2] são dissolvidos em 1 litro de água, obtemos um litro de hidróxido de cálcio à 1 Molar por litro. Por isso, precisaremos de 7,4 (74/(2x5)) gramas de [Ca(OH)2] em 200 mililitros de água, para obter 0,2 (1/5) litros de solução de hidróxido de cálcio à 0,5 (1/2) Molar por litro.
Se 98 g/mol de [H3PO4] são dissolvidos em 1 litro de água, obtemos um litro de ácido fosfórico à 1 Molar por litro. Por isso, precisaremos de 14,7 (98x0,3/2) gramas de ácido fosfórico em meio litro de água, para obtermos meio (1/2) litro de solução de ácido fosfórico à 0,3 (1x0,3) Molar por litro.
Considerando estes fatos químicos, preparamos 200 mililitros de hidróxido de cálcio à 0,5 Molar utilizando uma balança para pesar 7,4 gramas do pó de hidróxido de cálcio, colocando este material em um beker graduado e completando com água destilada até 200 mililitros de solução.
Depois a partir do ácido fosfórico líquido em uma densidade de 1710 gramas por litro, utilizando uma pipeta com pera de borracha e uma proveta graduada, transferimos 8 mililitros (14,7 gramas) de ácido fosfórico para uma proveta dentro de uma capela, protegendo-nos dos vapores tóxicos deste ácido volátil. Completamos a solução com água destilada, dentro de um balão volumétrico, até 500 mililitros de solução.
Colocamos a solução de hidróxido de cálcio à 0,5M em um beker dentro de um banho maria com controle de temperatura fixa em 40 graus Celsius. Montamos uma bureta de 50 mililitros em cima do beker de forma a conseguir aproximadamente 2 gotas por segundo na suspenção de hidróxido de cálcio. Gotejamos 200 mililitros do ácido fosfórico em 4 doses de 50 mililitros. Todo este procedimento demorou cerca de 6 horas. Sendo que talvez 30 minutos para preparar as soluções do ácido e da base, 30 minutos em trânsito entre os laboratórios e 5 horas de "paciência esperançosa" vendo gotas de ácido pingando e formando "osso sintético"!
Depois foi necessário secar a água. Utilizamos primeiramente o processo de sedimentação, retiramos com uma "pipeta canudo" a água sobressalente. Colocamos a pasta de hidroxiapatita molhada em um prato e secamos ao sol. Foi possível ter a alegria de sintetizar osso inorgânico com simplicidade e poucos recursos, agora temos a esperança de realmente termos hidroxiapatita com uma pureza satisfatória.